 A farmacêutica possui a autorização desde 11 de dezembro de 2020. Foto: Reprodução © Fornecido por Estadão
A farmacêutica possui a autorização desde 11 de dezembro de 2020. Foto: Reprodução © Fornecido por EstadãoLeitores solicitaram esta checagem pelo WhatsApp, no número (11) 97683-7490.
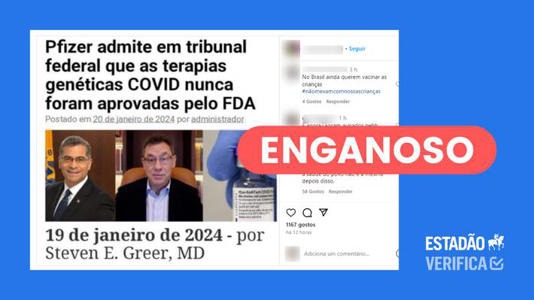
Saiba mais: Circula no WhatsApp e no Facebook a imagem de uma manchete, em português, que diz: “Pfizer admite em tribunal federal que as terapias genéticas Covid nunca foram aprovadas pelo FDA”. A alegação é acompanhada das fotos de Xavier Becerra, secretário de Saúde e Serviços Humanos dos Estados Unidos, e de Albert Bourla, executivo-chefe da farmacêutica.
Fazendo a busca reversa da imagem, o Estadão Verifica identificou tratar-se de uma tradução do texto “Pfizer admits in federal court that the COVID gene therapies were never approved through the FDA”, redigido pelo médico norte-americano Steven E. Greer e publicado no site Greer Journal.
O conteúdo não prova que as vacinas para covid-19 da Pfizer não foram aprovadas pela FDA e sequer que a farmacêutica tenha admitido isso a uma corte federal. Como dito anteriormente, autorização para a vacina contra covid entrou em vigor em 11 de dezembro de 2020.
A publicação distorce um documento que o autor atribui à farmacêutica, supostamente oriundo de um processo jurídico que tramita no Tribunal Distrital dos Estados Unidos para o Distrito Leste do Texas. O Verifica não conseguiu atestar a veracidade do documento; a Pfizer afirmou que não verifica ou confirma documentos circulando na internet.
A ação judicial foi movida por uma ex-funcionária da empresa Ventavia Research Group, terceirizada da Pfizer e acusada pela denunciante de ter falsificado dados da vacina contra a covid-19. As denúncias da mulher chegaram a ser noticiadas pelo Jornal Médico Britânico (BMJ, na sigla em inglês).
O texto que deu origem às postagens aqui checadas usa o suposto documento da Pfizer para criticar a lei norte-americana que permite o uso de medicamentos e dispositivos médicos durante emergências.
Ao longo dos parágrafos, o autor diz que as vacinas da Pfizer seriam “terapias genéticas mortais”, o que o Verifica mostrou ser falso. Ele afirma ainda que a farmacêutica teria argumentado que o secretário de Saúde Xavier Becerra tem o direito de aprovar o uso dos imunizantes sem ver quaisquer dados reais de ensaios clínicos. Segundo o autor do texto, a legislação americana permitiria ao Departamento de Segurança Interna obter a aprovação de qualquer “arma biológica” apelando diretamente ao secretário da Saúde e teria sido dessa forma que a vacina da Pfizer teria obtido autorização de uso no país. Mas nada disso é verdade.
Na verdade, a lei mencionada no texto foi criada para dar novas ferramentas para aprovação de medicamentos e dispositivos médicos para proteger a população americana contra ataques químicos, biológicos, radiológicos e nucleares. A legislação faz parte do Projeto BioShield, sancionado em 2004 como parte das ações da “Guerra ao Terror” do governo George W. Bush. Dentro dessa lei, está o mecanismo de aprovação de uso emergencial de medicamentos.
A lei diz que o secretário da Saúde poderá emitir uma autorização somente após consultar o Secretário Adjunto de Preparação e Resposta, o Diretor dos Institutos Nacionais de Saúde e o Diretor dos Centros de Controle de Doenças e Prevenção. Além disso, o secretário da Saúde precisa concluir que existe uma condição grave ou potencialmente fatal (no caso da vacina, a pandemia de coronavírus). A decisão deve ser tomada com base na totalidade das evidências científicas disponíveis, incluindo dados de ensaios clínicos adequados e controlados. Por fim, deve avaliar se os benefícios conhecidos e potenciais do produto superam os riscos conhecidos e potenciais dele.
A ação judicial movida pela ex-funcionária da empresa Ventavia Research Group contra a Pfizer cita a lei em questão. Detalhes do processo, ao qual a reportagem não teve acesso, são explicados detalhadamente em um artigo escrito por Dorit Rubinstein Reiss, professora de Direito da Universidade da Califórnia. A denúncia inicial foi rejeitada em março de 2023, mas a ex-funcionária recorreu e a atual manifestação atribuída à Pfizer é de janeiro de 2024. A manifestação pede que a Corte rejeite novamente a denúncia.
FDA garante que vacinas atendem aos padrões de segurança, eficácia e qualidade
A agência regulatória norte-americana garantiu ao Estadão Verifica que “as vacinas contra a covid-19 aprovadas e autorizadas pela FDA atendem aos altos padrões da agência em termos de segurança, eficácia e qualidade de fabricação”.
O órgão também enviou links para consulta em seu site, onde informa que as autorizações para uso emergencial levam em consideração a totalidade das evidências científicas disponíveis sobre a vacina e que os imunizantes são rigorosamente testados em ensaios clínicos.
A entidade também explica o passo a passo para a aprovação emergencial. Após o ensaio clínico em humanos concluir quão bem uma vacina previne a covid-19, o conselho de monitoramento de segurança de dados da agência revisa os dados e informa o fabricante dos resultados. Com base nisso, o fabricante decide se vai submeter um pedido de autorização emergencial.

Submetida a solicitação, cientistas e médicos da FDA avaliam todas as informações incluídas na documentação. Depois, ocorre uma reunião pública do Comitê Consultivo de Vacinas e Produtos Biológicos Relacionados, composto por especialistas externos científicos e de saúde pública do país. Nesta reunião, são discutidos os dados de segurança e eficácia para que o público e a comunidade científica tenham uma compreensão clara daquilo que a FDA está avaliando.
Após isso, a equipe da FDA considera a contribuição dos membros do comitê consultivo para continuar a avaliação da solicitação e determinar se a segurança e a eficácia disponíveis e os dados de fabricação apoiam a autorização de uso emergencial.
Por fim, caso ocorra a aprovação, é feito o monitoramento da segurança das vacinas pós-autorização pela FDA e pelos Centros de Controle e Prevenção de Doenças (CDC) dos EUA, juntamente com outras agências envolvidas na prestação de cuidados de saúde e dos fabricantes.
Pfizer destaca que o benefício da vacinação se sobrepõe a qualquer risco.
Além de não confirmar a autenticidade do documento, a Pfizer destacou que as agências regulatórias pelo mundo, como a FDA, autorizaram o uso da vacina com base em avaliações robustas e independentes de dados científicos de qualidade, segurança e eficácia, incluindo estudo clínico de fase 3. “Além disso, dados de estudos de mundo real complementam as informações dos estudos clínicos e proporcionam evidência adicional de que a vacina fornece proteção eficaz contra formas graves da doença”, afirma a nota enviada à redação.
A farmacêutica destaca já ter distribuído globalmente mais de 4,7 bilhões de doses da vacina ComiRNAty em mais de 181 países e não há, até o momento, qualquer alerta de segurança ou preocupação, de modo que o benefício da vacinação segue se sobrepondo a qualquer risco.
Por fim, a Pfizer lembra que os eventos adversos que podem ser relacionados à vacina identificados durante as fases de estudo pré e pós comercialização constam na bula do produto.